Le Directive européenne sur les médicaments falsifiés (FMD), les acteurs de la chaîne d'approvisionnement pharmaceutique commerciale réfléchissent à la sérialisation et aux systèmes de suivi et de traçabilité. Pour les chaînes d'approvisionnement des essais cliniques, l'accent est davantage mis sur l'étiquetage des produits individuels. Cela comprend à la fois l'impression des étiquettes et la vérification de leur contenu, qui jouent tous deux un rôle important dans le respect des exigences réglementaires.
Dans la première partie de cette série de blogs en deux parties, nous avons abordé les défis liés à l'étiquetage des médicaments utilisés dans les essais cliniques. Dans la partie 2, nous discuterons des solutions pour surmonter ces défis, y compris l'utilisation du logiciel Systech's T11 Marquage et vérification manuels
La réglementation européenne relative à l'étiquetage des médicaments expérimentaux (IMP) et des médicaments auxiliaires (AMP) utilisés dans les essais cliniques de l'industrie pharmaceutique est stricte, et ce pour de bonnes raisons. Les étiquettes fournissent aux administrateurs des essais cliniques et aux sujets des informations essentielles telles que la posologie, les instructions d'administration, le mode de conservation et la date de péremption. Toute erreur d'étiquetage peut compromettre la sécurité des participants et l'intégrité des données de l'essai clinique.
Il n'est pas toujours facile de se conformer aux réglementations en matière d'étiquetage. Les exigences peuvent être extrêmement complexes, en particulier lorsque les essais cliniques sont menés dans plusieurs pays. La plupart des pays exigent que les AMP et les Étiquettes IMP et d'autres informations dans leur(s) langue(s) préférée(s). Chaque pays, ainsi que les sites spécifiques, peuvent également avoir leurs propres exigences en matière d'étiquetage.
L'étiquetage des essais cliniques est d'autant plus compliqué que toute mise à jour du médicament ou de sa manipulation pendant ou entre les phases d'essais cliniques nécessite des modifications de l'étiquette. Par exemple, de nouvelles informations sur la stabilité des médicaments expérimentaux apparaissent souvent au cours des essais cliniques. Dans ce cas, les médicaments expérimentaux doivent être réétiquetés avec des dates de péremption actualisées et d'autres informations.
Tout changement ouvre la voie à des erreurs, ce qui renforce l'importance de la vérification des étiquettes au cours du processus d'impression. Bien que les avantages des étiquettes électroniques (eLabels) permettent de limiter les erreurs, l'UE exige toujours que Étiquettes IMP être imprimée.
En outre, les tirages des étiquettes utilisées dans les essais cliniques sont généralement faibles par rapport à ceux des étiquettes pharmaceutiques standard. L'investissement dans de grands systèmes intégrés d'impression et de vérification n'est donc pas envisageable, sans compter que la plupart des organisations qui réalisent des essais cliniques ne disposent pas de l'espace nécessaire à l'installation d'équipements à grande échelle. L'externalisation est une option, mais la nécessité de tenir compte des changements fréquents dans le contenu des étiquettes rend ce choix inefficace et augmente le risque de retards.
Comme si les organisations n'avaient pas assez à faire en termes d'étiquettes pour les essais cliniques, elles doivent maintenant aussi faire face à l'obligation d'étiquetage. Règlement de l'Union européenne sur les essais cliniques 536/2014 (EU CTR). Bien qu'elle vise à harmoniser les règles relatives à la conduite des essais cliniques dans l'ensemble de l'UE, elle ajoute également de la confusion.
La CTR de l'UE est entrée en vigueur le 31 janvier 2022, remplaçant la CTR de l'UE. Directive de l'Union européenne sur les essais cliniques (EU CTD) 2001/20/CE.Les exigences de l'UE en matière d'étiquetage des produits ne font plus partie des exigences de BPF décrites dans l'annexe 13 pour les médicaments expérimentaux (sections 26-33), mais du texte législatif du RCT, articles 66-70. Les exigences spécifiques relatives à l'étiquetage des produits expérimentaux pour les essais cliniques de l'UE sont détaillées dans l'annexe VI du RCT de l'UE. Une période de transition de trois ans est prévue pour son adoption. Les paragraphes suivants donnent un aperçu des exigences en matière d'étiquetage des médicaments expérimentaux dans le cadre du RCT de l'UE.
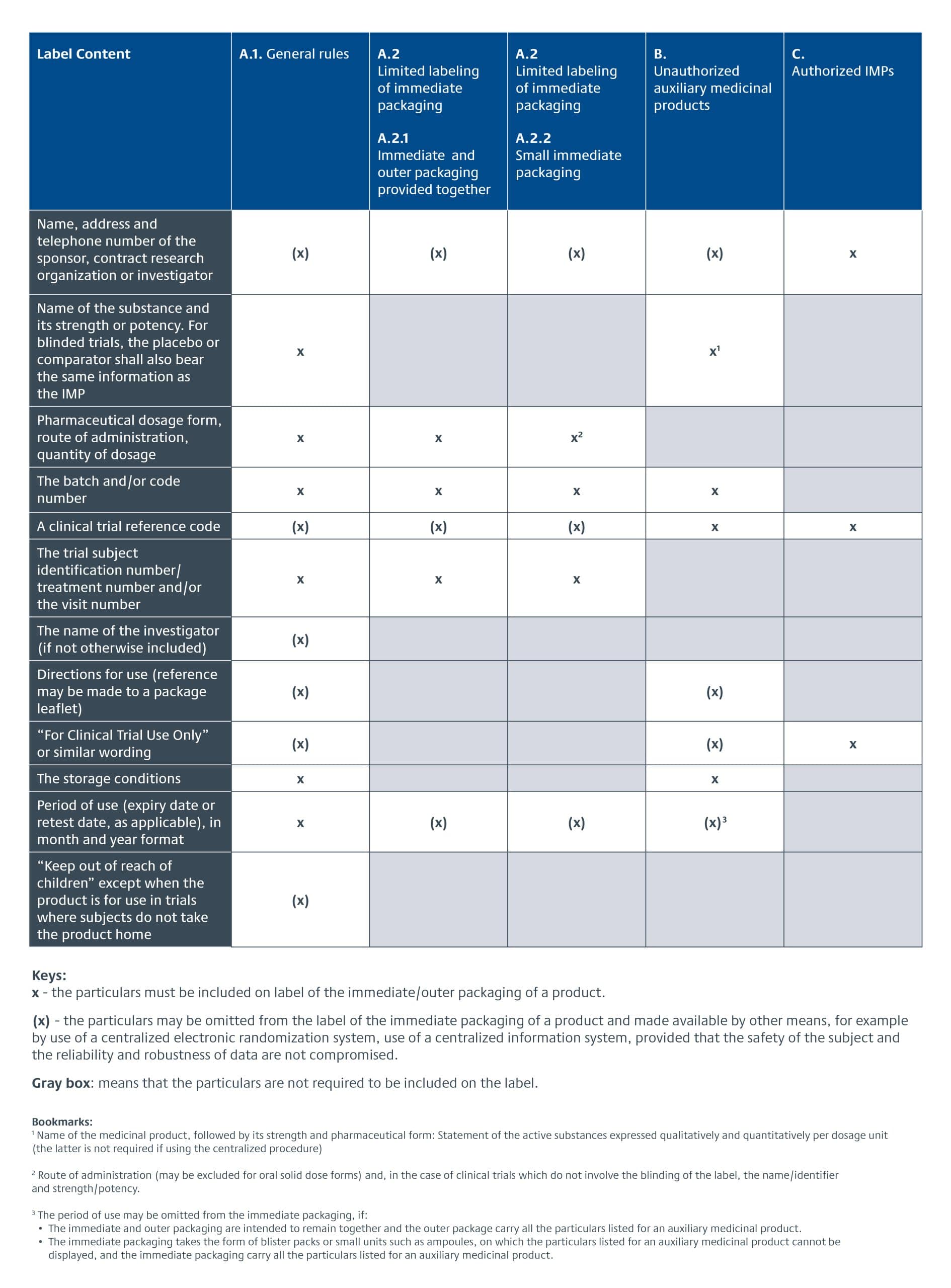
En outre, le nouveau système d'information sur les essais cliniques (CTIS) est entré en service le 31 janvier 2023. Il s'agit désormais du point d'entrée unique pour la soumission des données et des informations relatives aux essais cliniques requises par le RTC de l'UE. Les promoteurs d'essais cliniques ont eu un an pour passer au nouveau système.
La plus grande confusion réside dans le fait de savoir si c'est l'EU CTR ou l'EU CTD qui s'applique aux exigences d'étiquetage des médicaments expérimentaux. Les essais cliniques soumis dans le cadre de l'EU CTR doivent se conformer aux nouvelles exigences en matière d'étiquetage.
À partir du 31 janvier 2024, date de la fin de la période de transition vers le CTIS, toutes les demandes d'essais cliniques devront être soumises par l'intermédiaire du CTIS et seront soumises à la réglementation du CTR de l'UE. Les essais cliniques existants autorisés dans le cadre du CTD de l'UE, qui pourraient inclure tous les essais soumis avant le 31 janvier 2024, peuvent conserver leur étiquetage d'origine.
Un autre facteur à prendre en compte concernant les exigences en matière d'étiquetage pour les essais cliniques est la personne qualifiée (PQ). En vertu de la législation de l'Union européenne (UE), la personne qualifiée certifie que chaque lot d'un médicament satisfait à toutes les dispositions requises lorsqu'il est libéré d'une installation de fabrication au sein de l'UE ou importé dans l'UE. Bien que le RCT de l'UE ait été adopté, son interprétation peut varier d'une personne qualifiée à l'autre. Il est impératif que le promoteur du médicament et le QU s'accordent sur la stratégie et le contenu de l'étiquetage afin d'éviter les problèmes de conformité et les retards dans les délais.
Il existe également une modification de l'annexe VI qui a été adoptée en septembre 2022 et qui est entrée en vigueur dès sa publication au Journal officiel de l'Union européenne le 15 novembre 2022. Elle supprime l'obligation d'indiquer la date de péremption sur le conditionnement primaire de certains médicaments expérimentaux utilisés dans le cadre d'essais cliniques.
Malgré les difficultés, il est essentiel de pouvoir produire des étiquettes sans erreur en fonction des besoins et au moment opportun. Gardez à l'esprit que :
En partie 2 Dans cette série de blogs, nous aborderons quelques-unes des options pour la production d'étiquettes d'essais cliniques et les caractéristiques à rechercher pour répondre aux critères susmentionnés.